© Всі права захищено. Представництво "Пфайзер Експорт. Бі. Ві. " в Україні (2018).
Виключно для фахівців охорони здоров'я України
Стратегія вибору антикоагулянтної терапії у пацієнтів із неклапанною фібриляцією передсердь
Пацієнтам із фібриляцією передсердь неклапанної етіології (нФП) з метою запобігання розвитку тромбоемболічних ускладнень можна призначати прямі пероральні антикоагулянти (ПОАК). За результатами рандомізованих клінічних досліджень, ПОАК не поступаються антагоністам вітаміну К (АВК) або перевершують їх в ефективності (профілактика ішемічного інсульту / системної емболії) і мають переваги щодо безпеки (нижчий ризик геморагічних ускладнень). На відміну від АВК, при застосуванні ПОАК відсутня необхідність рутинного лабораторного контролю стану коагуляції. Але який саме ПОАК призначити конкретному хворому? Чи буде антикоагулянт ефективним та безпечним за наявності тих чи інших коморбідних станів у літніх пацієнтів? Відповіді на ці запитання шукали учасники симпозіуму в межах Х ювілейної науково-практичної конференції Асоціації аритмологів України, що відбулася 1-3 липня 2020 року.

Про поліморбідність у пацієнта із нФП йде мова за наявності ≥3 хронічних захворювань. Така значна кількість супутніх станів є маркером крихкості (старечої немочі), підвищує ризик поліпрагмазії та розвитку небажаних явищ лікарських засобів. В осіб із нФП коморбідна патологія також пов’язана зі зростанням імовірності розвитку тромбоемболії та кровотеч, що було підтверджено в субаналізі дослідження ARISTOTLE (Alexander et al., 2018).
Лектор нагадав, що у рандомізованому подвійному сліпому випробуванні ARISTOTLE (n=18 201), в якому брав участь Інститут кардіології ім. акад. М.Д. Стражеска, порівнювали ефективність і безпеку апіксабану, інгібітора Хафактора зсідання крові, та препарату групи АВК варфарину в пацієнтів із нФП. Апіксабан (5 мг двічі на день) продемонстрував суттєві переваги порівняно з варфарином (цільове міжнародне нормалізоване відношення [МНВ] 2,03,0).
У групі апіксабану отримані такі результати порівняно з варфарином (Granger et al., 2011):
У субаналізі випробування ARISTOTLE ефективність і безпеку апіксабану та варфарину порівнювали в 16 800 осіб віком ≥55 років із нФП та поліморбідністю (Alexander et al., 2018). На початку дослідження було зібрано інформацію про наявність в учасників 17 різних коморбідних станів, зокрема захворювань ендокринної, серцевосудинної, опорнорухової, травної, дихальної систем, нирок, крові тощо.
Залежно від кількості наявних супутніх патологій хворих поділили на три категорії: 02 коморбідних захворювання у 36,2% пацієнтів, 35 – у 50,6%; ≥ 6 – у 13,2%. Період спостереження становив у середньому 1,8 року. Поліморбідність виявлено у 63% хворих, причому ті, в кого було ≥ 3 коморбідних станів, частіше були старшими за тих, хто мав 02 супутні захворювання, вищий ризик розвитку інсульту за шкалою CHA2DS2VASc та отримував удвічі більше препаратів. Частота виникнення інсульту / системної емболії, великої кровотечі та смерті з розрахунку на 100 пацієнтороків була вищою серед хворих із більшою кількістю коморбідних станів навіть з огляду на вік, стать, расу та регіон проживання.
Порівняння ефективності й безпеки апіксабану і варфарину в осіб із нФП та різною кількістю коморбідностей показало, що апіксабан має переваги щодо частоти інсульту / системної емболії, великих кровотеч і смерті в усіх категоріях пацієнтів. Особливо треба відзначити зниження ризику внутрішньочерепної кровотечі у паці єнтів, які отримували апіксабан, порівняно з тими, хто застосовував варфарин. Хворі на апіксабані мали 6+ су путніх патологій: відносний ризик (ВР) 0,28; 95% довірчий інтервал (ДІ) 0,090,84 (Alexander et al., 2018). Таким чином, ефективність та безпеку апіксабану, а також його переваги перед АВК доведені у поліморбідних пацієнтів із нФП.
Професор О.С. Сичов звернув увагу слухачів на такий важливий аспект терапії пацієнтів із нФП, як лікарські взаємодії. Так, апіксабан є субстратом транспортного Рглікопротеїну та цитохрому CYP3A4, що бере участь у метаболізмі апіксабану в печінці. Варфарин – субстрат низки печінкових цитохромів. Як на ефекти апіксабану та варфарину впливають інші лікарські засоби, що отримує хворий? Відповідь на це запитання було отримано внаслідок проведення спеціального субаналізу результатів дослідження ARISTOTLE.
До субаналізу були включені 5547 пацієнтів, з яких 2722 одночасно отримували апіксабан та препарати, що потенційно могли з ним взаємодіяти (комбіновані інгібітори або індуктори Рглікопротеїну та CYP3A4), а 2825 – варфарин і ліки, які потенційно могли з ним взаємодіяти. Серед учасників переважали жінки, хворі, які застосовували ацетилсаліцилову кислоту (АСК) та мали кровотечі в анамнезі. Вплив взаємодій лікарських засобів на ефекти апіксабану та варфарину порівнювали за допомогою моделювання пропорційних ризиків Кокса. Субаналіз дослідження ARISTOTLE не виявив значної різниці щодо ефективності (ризик інсульту та системної емболії) і безпеки (ризик великих кровотеч) препаратів (Washam et al., 2019). Це має принципове значення в терапії нФП, адже таким пацієнтам часто призначають ліки, які можуть взаємодіяти із ПОАК.
Певні труднощі становить антикоагулянтна терапія у літніх пацієнтів із нФП через поширеність у цій популяції хронічної хвороби нирок (ХХН), підвищеного ризику кровотеч/ інсульту, поліпрагмазії, травм через падіння (Kirchhof et al., 2016). Згідно з даними дослідження ARISTOTLE за участю 31% пацієнтів ≥75 років, апіксабан показав переваги перед варфарином у всіх вікових групах (Granger et al., 2011):
Важливо зазначити, що апіксабан перевершує варфарин, зокрема, й у хворих старечого віку зі значним порушенням функції нирок (швидкість клубочкової фільтрації [ШКФ] ≤30мл/хв) щодо зниження ризику як інсульту та системної емболії (ВР 0,29; 95% ДІ 0,081,07), так і великих кровотеч (ВР 0,35; 95% ДІ 0,140,86) (Halvorsen et al., 2014). Таким чином, у пацієнтів літнього віку із нФП апіксабан запобігає більшій кількості інсультів та пов’язаний із меншим ризи ком великих кровотеч порівняно з варфарином.
Для оптимізації фармакотерапії пацієнтів віком ≥65 років 2008 р. було створено класифікацію FORTA (Fit fOR The Aged – «підходить для літніх людей»). Відповідно до класифікації препарати поділено на чотири класи на підставі користі й безпеки для хворих похилого та старечого віку (Wehling, 2013). Вісім препаратів були розглянуті з позиції тривалої терапії нФП в осіб похилого віку шляхом комплексного аналізу якості, результатів клінічних досліджень і оцінки групою з десяти європейських експертів (OAC FORTA, 2016). Апіксабан був класифікований як FORTAA (найбільш оптимальний коефіцієнт ризику та користі) та препарат, що має велику доказову базу із застосування у літніх людей (Wehling et al., 2017).
Олег Сергійович акцентував на важливості правильного призначення дози ПОАК. Адже за результатами дослідження ORBITAFII один із семи пацієнтів із нФП отримує ПОАК у низькій дозі, причому в більшості випадків підстав для її зменшення, згідно з інструкцією, немає. Хворі, які безпідставно отримували знижену дозу ПОАК, порівняно з тими, хто приймав стандартну, мали підвищений ризик тромбоемболічних подій (ВР 1,56; 95% ДІ 0,922,67) та смерті (ВР 2,61; 95% ДІ 1,863,67) (Steinberg et al., 2019).
Тож слід пам’ятати, що всі ПОАК мають два рекомендованих режими дозування. Відповідно до інструкції, стандартна доза апіксабану становить 5 мг двічі на день. Нижчу дозу апіксабану 2,5 мг два рази на добу застосовують у пацієнтів, які відповідають принаймні двом із трьох критеріїв ABC:
A (age) – вік ≥80років;
B (body) – маса тіла ≤60 кг;
C (creatinine) – рівень креатині ну ≥1,5 мг/дл. Окрім того, знижену дозу апіксабану призначають особам із тяжкою нирковою недостатністю, коли кліренс креатиніну (КК) становить 1529 мл/хв.

Також було зазначено, що за результатами дослідження ARISTOTLE у пацієнтів із нФП та пізніми стадіями ХХН (КК 2530 мл/хв.), які отримували апіксабан у дозі 5 або 2,5 мг двічі на день, спостерігалася нижча частота кровотеч, ніж у групі варфарину. При цьому різниця у частоті була суттєвішою, ніж в осіб із КК >30 мл/хв (Stanifer et al., 2020).
Олена Миколаївна акцентувала на тому, що на сьо годні КК <15 мл/хв є протипоказанням до призначення ПОАК (виключення – апіксабан у США). Однак серед таких пацієнтів нФП є поширенішою (1113%), ніж у загальній популяції, при цьому вони мають у 1,5 рази вищий ризик розвитку інсульту та удвічі – кровотеч (Olesen et al., 2012). Застосування варфарину в даній групі хворих пов’язане з додатковою небезпекою, зокрема складністю контролю МНВ та підвищеною кальцифікацією ниркових судин. Тому існує нагальна потреба у дослідженні можливостей антикоагулянтної терапії для пацієнтів із нФП та термінальною стадією ХХН.
У 2019 р. були оприлюднені результати RENALAF – першого рандомізованого дослідження безпеки ПОАК (апіксабану) порівняно з варфарином в осіб із нФП та термінальною стадією ХХН на гемодіалізі. Учасники отримували апіксабан (5 мг два рази на добу; 2,5 мг двічі на день у деяких хворих) або варфарин (цільове МНВ – 2,03,0).
Дослідження припинили передчасно, зокрема, через труднощі із залученням пацієнтів на гемодіалізі, але було продемонстровано подібні показники великих та клінічно значущих невеликих кровотеч у групах апіксабану та варфарину (Pokorney, 2019).
О.М. Романова приділила увагу веденню хворих на нФП та ЦД, адже відомо, що останній є фактором ризику розвитку інсульту та системної емболії в осіб із нФП. Цим пацієнтам було присвячено субаналіз результатів дослідження ARISTOTLE, в якому порівнювали ефективність і безпеку терапії апіксабаном та варфарином в осіб із нФП, пацієнтів із/без ЦД (Ezekowitz et al., 2014). Серед учасників приблизно 25% мали ЦД. У середньому вони демонстрували вищий ризик тромбоемболічних ускладнень за шкалою CHA DS VASc, ніж пацієнти без цієї недуги. Апіксабан показав переваги в ефективності порівняно з варфарином незалежно від наявності у хворого ЦД.
Особи із ЦД, які отримували апіксабан, продемонстру вали такі клінічні результати порівняно із варфарином:
Ризик великих кровотеч у пацієнтів із ЦД у групах апіксабану та варфарину був подібним (Ezekowitz et al., 2014).
На додачу, було проведено субаналіз у межах дослідження ARISTOTLE щодо прогностичної значимості ЦД з/без лікування інсуліном у великій когорті пацієнтів з нФП. Хворі застосовували антикоагулянт (ЦД відсутній, n=13 588; ЦД, що не лікується інсуліном: без ліків, n=1055; лише пероральні протидіабетичні препарати, n=2726; ЦД, що лікується інсуліном, n=832). В осіб із ЦД, що отримували інсулін, рівень смертності від ССЗ був значно вищим порівняно із хворими, що не використовували інсулін або не мали ЦД (De Caterina et al., 2019). При цьому жоден метод лікування ЦД не пов’язаний із підвищенням ризику інсульту / системної емболії (De Caterina et al., 2019).
Лекторка відзначила актуальність на світовому рів ні проблеми ожиріння, яке набуло масштабів пандемії. В Україні кількість осіб з ожирінням з 2001 по 2012 рр. зросла на 30% і надалі продовжує збільшуватися; надлишкову масу тіла мають 70% населення країни. Що стосується пацієнтів із нФП, за наявності ожиріння зниження ваги разом із контролем інших факторів ризику мусять бути розглянуті з метою зменшення тяжкості хвороби та виразності симптомів. Це підтверджують результати дослідження LEGACY (Pathak et al., 2015). Ожиріння має тісний патофізіологічний зв’язок із ФП, зокрема через хронічне запалення та перикардіальне ожиріння. Позбавлення надлишкової ваги – важлива складова лікування нФП.
Кореляцію між індексом маси тіла (ІМТ) та результатами антикоагулянтної терапії апіксабаном або варфарином вивчали у межах субаналізу дослідження ARISTOTLE. Згідно зі значенням ІМТ, учасників розподілили на три категорії: із нормальною (ІМТ <25 кг/м2), надлишковою вагою (ІМТ 2529 кг/м2), ожирінням (ІМТ >30 кг/м2). Пацієнти, які отримували апіксабан, при порівнянні з групою варфарину мали нижчий ризик інсульту / системної емболії, великих кровотеч та смерті з усіх причин неза лежно від значення ІМТ (Sandhu et al., 2015).
На завершення О.М. Романова підкреслила необхідність урахування коморбідностей пацієнтів при терапії нФП. Залишаються відкритими питання з приводу застосування ПОАК у пацієнтів із нФП на термінальній стадії ХХН, але вже сьогодні наявні свідчення ефективності та безпеки апіксабану в осіб із ХХН, ЦД та ожирінням.
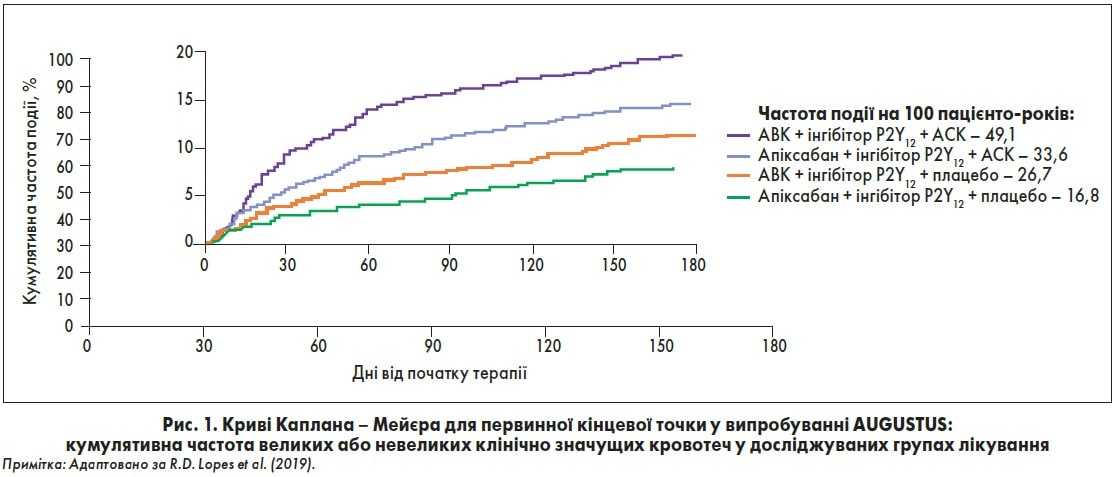
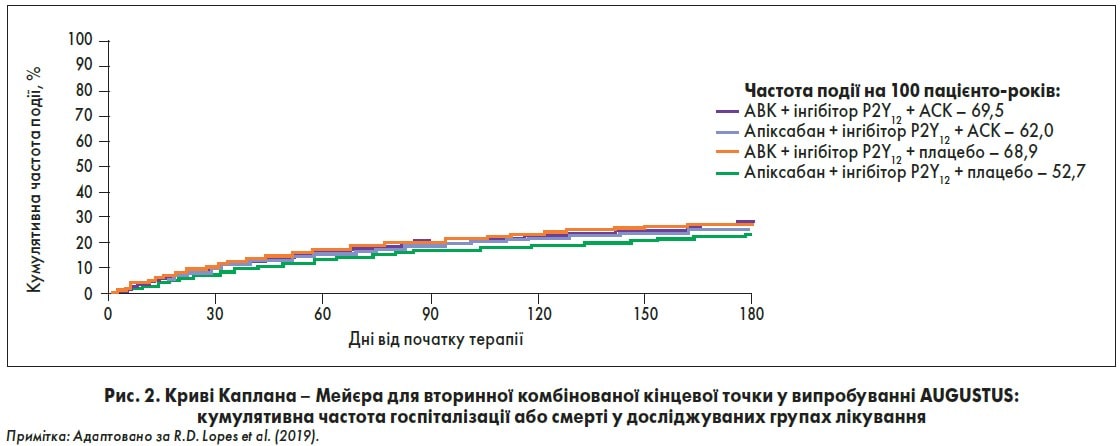

У 2019 р. було опубліковано результати випробування AUGUSTUS ACS/PCI, в якому порівнювали ефекти апіксабану та АВК як компонентів антитромботичної терапії у пацієнтів із нФП після ГКС або ЧКВ (Lopes et al., 2019). Як зазначив лектор, великою перевагою дослідження є клінічно правильний підхід до оцінки терапевтичної стратегії, адже порівнювані схеми лікування включали або не включали АСК.
В AUGUSTUS ACS/PCI був залучений 4641 пацієнт із нФП, що протягом останніх 14 днів переніс ГКС або ЧКВ, із середнім ризиком тромбоемболічних ускладнень за шкалою CHA 2DS2VASc 3,9 та кровотеч за шкалою HASBLEED 2,9. В усіх хворих критерієм включення у дослідження було попереднє призначення інгібітора P2Y12 принаймні на шість наступних місяців (92% отримували клопідогрель).
Пацієнтів рандомізували у чотири групи, які протягом шістьох місяців отримували одну з комбінацій:
Первинною кінцевою точкою виступала велика або клінічно значуща невелика кровотеча, вторинною – госпіталізація або смерть. У групах апіксабану спостерігалася менша кількість кровотеч, ніж при лікуванні з використанням АВК (ВР 0,69; 95% ДІ 0,580,81). Цей результат цілком узгоджувався з отриманими даними попередніх досліджень апіксабану або АВК (ARISTOTLE).
Також у черговий раз було показано, що включення до схем антитромботичної терапії АСК підвищує ризик кровотеч порівняно із плацебо (ВР 1,89; 95% ДІ 1,592,24). Най меншу ймовірність кровотеч мали пацієнти, які отримували апіксабан (5 мг двічі на день) + інгібітор P2Y12 + плацебо, найвищий – АВК (цільове МНВ – 2,03,0) + інгібітор P21Y2 + АСК (рис. 1). Що стосується ефективності комбінацій, суттєвої різниці щодо зниження ризику госпіталізації та смерті для різних схем лікування не було (рис. 2). Але при аналізі частоти різних ішемічних подій у групах апіксабану спостерігалися удвічі менша ймовірність розвитку інсульту (ВР 0,50; 95% ДІ 0,260,97) та на 17% – госпіталізацій (ВР 0,83; 95% ДІ 0,740,93), ніж у групах АВК. Включення АСК у схеми лікування практично не впливало на ризик ішемічних подій.
О.І. Іркін навів результати метааналізу досліджень PIONEER AFPCI, REDUAL, ENTRUSTAFPCI та AUGUSTUS ACS/PCI із загальною участю 10 234 хворих на нФП після ГКС та/або ЧКВ, де порівнювали ефективність і безпеку подвійної та потрійної антитромботичної терапії. Згідно з отриманими даними, подвійна антитромботична терапія, особливо при включенні ПОАК замість АВК та інгібітора P2Y12, пов’язана зі зниженням ризику кровотеч, зокрема великих та внутрішньочерепних. На томість потрійна терапія має певні переваги щодо ймовірності виникнення тромбозу стента (Gargiulo et al., 2019).
В оновленому мережевому метааналізі шести рандомізованих досліджень (n=12 158) стратегії антитромботичної терапії у пацієнтів із нФП після ЧКВ підтверджено, що застосування ПОАК та інгібітора P2Y 12 є безпечнішим та одночасно не менш ефективним, ніж комбінацій із АСК (Chua et al., 2020). Під час приймання АСК ризик розвитку кровотеч зростав як протягом перших 30 днів, так і надалі – до шести місяців тривалості дослід жен ня. Що стосується тромбозу стента, переваги АСК виявляли ся лише в перші 30 днів, а потім вплив препарату на їхню частоту не відрізнявся від плацебо (Alexander et al., 2020).
Насамкінець Олег Ігорович зазначив, що провідні професійні товариства підтримують призначення пацієнтам із нФП після ЧКВ подвійної терапії, що включає ПОАК та інгібітор P2Y12. Тоді як тривалість потрійної терапії, яку застосовують, коли високий ризик ішемічних подій переважає імовірність кровотеч, має бути якнайменшою – до 30 днів (Bainey et al., 2019).
Підготувала Тетяна Ткаченко
Статтю надруковано у медичній газеті "Здоров'я України" №4, Вересень 2020 за підтримки компанії «Пфайзер»